
- Autore Miles Stephen [email protected].
- Public 2023-12-15 23:37.
- Ultima modifica 2025-06-01 05:04.
Basicità. Rispetto alle ammine, ammidi sono basi molto deboli. Mentre l'acido coniugato di un'ammina ha un pKun di circa 9,5, l'acido coniugato di an ammide ha un pKun intorno a -0,5. Perciò, ammidi non hanno proprietà acido-base così chiaramente evidenti in acqua.
Inoltre è stato chiesto, qual è il pKa di un'ammina?
Il valore di 10,63 si riferisce in realtà al pKa dell'acido coniugato di metil ammina , NON la metilammina stessa. È un valore di pKaH. Allo stesso modo, la stessa tabella elenca la trimetilammina come avente a pKa di 9.8.
Inoltre, le ammidi possono essere protonate? UN ammide protonata possiede il gruppo meno acido di tutti (CONH+), prova che la forma di risonanza lampeggiante ha in questo caso un contributo schiacciante. La coppia solitaria di elettroni su NH2 è molto delocalizzata al gruppo carbonilico in ammidi . In realtà, il C=O. gruppo di an ammide è più basilare dell'NH2.
Allo stesso modo, potresti chiedere, qual è il pKa dell'idrossido?
Idrossido ione, HO(-) non è sul lato sinistro del pKa tabella, ma è sul "inverso" pKa tabella - è la base coniugata dell'acqua, H2O. L'acqua ha un pKa di ~15 e CH4 ha un pKa di 50. Il nostro prodotto è un acido più forte. Dall'inverso pKa tabella, notiamo anche che CH3(-) è una base più forte di HO(-).
Perché le ammidi sono fondamentali?
A differenza delle ammine, che sono basi decenti, ammidi sono basi deboli. Gli acidi coniugati di ammidi hanno valori di pKa di circa -0,5. La ragione ammidi non sono così di base è dovuto alla presenza dei gruppi carbonilici. ammidi possono anche legarsi a idrogeno perché contengono un legame N-H.
Consigliato:
Qual è il pKa degli acidi forti?

Gli acidi forti sono definiti dal loro pKa. L'acido deve essere più forte in soluzione acquosa di uno ione idronio, quindi il suo pKa deve essere inferiore a quello di uno ione idronio. Pertanto, gli acidi forti hanno un pKa di <-174
Perché un tampone funziona meglio a un pH vicino al suo pKa?
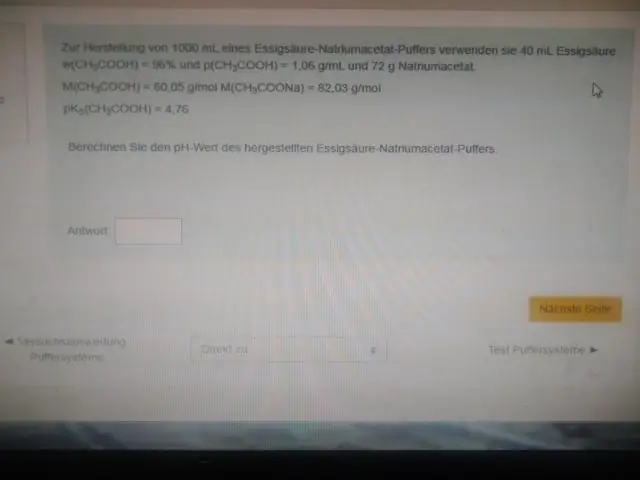
In altre parole, il pH della soluzione equimolare di acido (ad esempio, quando il rapporto tra la concentrazione di acido e base coniugata è 1:1) è uguale al pKa. Questa regione è la più efficace per resistere a grandi variazioni di pH quando si aggiunge acido o base. Una curva di titolazione dimostra visivamente la capacità del tampone
Qual è il pKa approssimativo di un tiolo?

6.4 Inoltre è stato chiesto, qual è il pKa del tiolo? tioli sono più acidi degli alcoli in media di circa 5 pKa unità o giù di lì ( pKa di circa 11 per il tiolo nella foto sotto). Ricordati che pKa è logaritmico, quindi significa che sono circa 10 5 volte più acido.
Qual è il significato del valore pKa?

Punti chiave: definizione di pKa Il valore di pKa è un metodo utilizzato per indicare la forza di un acido. pKa è il log negativo della costante di dissociazione acida o valore Ka. Un valore pKa più basso indica un acido più forte. Cioè, il valore più basso indica che l'acido si dissocia più completamente in acqua
Cos'è un'ammide in chimica?

Un'ammide è un gruppo funzionale contenente un gruppo acarbonile legato a un atomo di azoto o qualsiasi composto contenente il gruppo funzionale ammidico. Le ammidi sono derivate dall'acido carbossilico e da un'ammina. L'ammide è anche il nome dell'anione inorganico NH2
