- Autore Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Ultima modifica 2025-01-22 17:02.
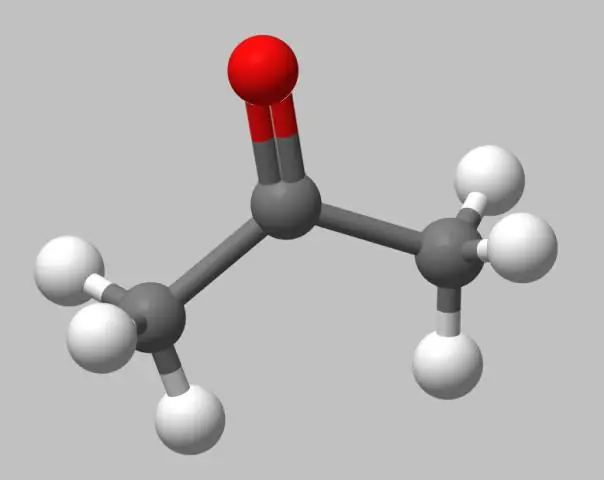
Modelli con palla e bastone . Modelli con palla e bastone non sono realistici come riempiono lo spazio Modelli , perché gli atomi sono rappresentati come sfere di raggi più piccoli dei loro raggi di van der Waals. Tuttavia, l'accordo di legame è più facile da vedere perché i legami sono esplicitamente rappresentati come bastoni.
Successivamente, ci si potrebbe anche chiedere, cosa rappresenta il modello palla e bastone?
In chimica, il modello a palla e bastone è un molecolare modello di una sostanza chimica che deve visualizzare sia la posizione tridimensionale degli atomi sia i legami tra di essi. Gli atomi sono tipicamente rappresentato da sfere, collegate da aste che rappresentare le obbligazioni.
Inoltre, in che modo un modello di riempimento dello spazio è diverso da un modello a sfera e bastone? Modelli a sfera e bastone sono tridimensionali Modelli dove gli atomi sono rappresentati da sfere di diverso i colori e i legami sono rappresentati da bastoni tra le sfere. Modelli di riempimento dello spazio sono simili a modelli di palla e bastone in quanto sono tridimensionali Modelli che rappresentano gli atomi come sfere colorate.
In questo caso, perché il modello della palla e del bastone non è accurato?
Il modello di palla e bastone è non un vero rappresentazione della struttura del solfuro di potassio. 3.3) Lo zolfo può anche formare legami covalenti. 3.6) I composti ionici come il solfuro di potassio hanno punti di ebollizione elevati e conducono elettricità quando disciolti in acqua.
L'acqua è polare o non polare?
Acqua (H2O) è polare a causa della forma piegata della molecola. La forma significa che la maggior parte della carica negativa dall'ossigeno sul lato della molecola e la carica positiva degli atomi di idrogeno è sull'altro lato della molecola. Questo è un esempio di polare legame chimico covalente.
Consigliato:
Una palla che rotola giù per una collina ha energia potenziale?

Se metti una palla in cima alla collina a sinistra, è in alto, quindi ha energia potenziale. Ora, se gli permetti di rotolare giù per la collina, cambia quell'energia potenziale in energia cinetica (diventa meno alta e inizia a rotolare più velocemente)
Perché il modello di Rutherford è chiamato modello nucleare?

Il modello dell'atomo di Rutherford è chiamato atomo nucleare perché è stato il primo modello atomico a presentare un nucleo al suo interno
Cosa c'è di più denso di una palla da bowling o di una palla da basket Come fai a saperlo?

Poiché la palla da bowling è più pesante della palla da basket, sai che deve essere più densa, poiché entrambe occupano la stessa quantità di spazio in generale. Un altro esempio a cui pensare è se hai mai fatto una torta e hai dovuto setacciare la farina
Perché il modello di Bohr potrebbe essere chiamato modello planetario dell'atomo?

Il motivo per cui viene chiamato "modello planetario" è che gli elettroni si muovono attorno al nucleo proprio come i pianeti si muovono attorno al sole (tranne che i pianeti sono tenuti vicino al sole per gravità, mentre gli elettroni sono tenuti vicino al nucleo da qualcosa chiamato una forza di Coulomb)
Perché una palla che rotola liberamente alla fine si ferma?

Quando fai rotolare una palla a terra, gli elettroni negli atomi sulla superficie del terreno spingono contro gli elettroni negli atomi sulla superficie della tua palla che tocca il suolo. Una palla rotolante si ferma perché la superficie su cui rotola resiste al suo movimento. Una palla rotolante si ferma a causa dell'attrito
