
- Autore Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Ultima modifica 2025-01-22 17:02.
Atomico spettri di emissione derivano da elettroni che cadono da livelli di energia più alti a livelli di energia più bassi all'interno del atomo , vengono rilasciati fotoni (pacchetti di luce) con lunghezze d'onda specifiche.
Proprio così, cosa causa lo spettro di emissione?
Così, spettri di emissione sono prodotti da gas sottili in cui gli atomi non subiscono molte collisioni (a causa della bassa densità). Il emissione le linee corrispondono a fotoni di energie discrete che sono emesso quando gli stati atomici eccitati nel gas ritornano ai livelli inferiori.
perché lo spettro di emissione è unico per ogni elemento? Spettro di emissione di ogni elemento è distinto perché ogni elemento ha un diverso insieme di livelli di energia degli elettroni. Il emissione le linee corrispondono alle differenze tra le varie coppie dei molti livelli energetici. Le linee (fotoni) sono emesso quando gli elettroni cadono da orbitali di energia più alta a energie più basse.
Di conseguenza, come viene prodotto uno spettro di emissione atomica di un elemento?
Un spettro di emissione atomica è lo schema delle linee formato quando la luce passa attraverso un prisma per separarlo nelle diverse frequenze di luce che contiene. Allo stesso modo, quando il atomi rilassato in uno stato di energia inferiore, qualsiasi quantità di energia potrebbe essere rilasciata.
Perché lo spettro di emissione di un elemento viene considerato come la sua impronta digitale?
Atomico spettri di emissione sono unici spettri di luce emesso di an elemento quando l'elettricità è attraversata o quando è vista attraverso un prisma. Poiché sono unici, possono agire come un elemento S impronta digitale . È un insieme di frequenze di il elettromagnetico spettro emesso da eccitato elementi di un atomo.
Consigliato:
Cosa causa le righe nello spettro di emissione degli elementi?

Le righe di emissione si verificano quando gli elettroni di un atomo, elemento o molecola eccitato si spostano tra i livelli di energia, tornando verso lo stato fondamentale. Le righe spettrali di uno specifico elemento o molecola a riposo in un laboratorio si presentano sempre alle stesse lunghezze d'onda
In che modo uno spettro di emissione atomica è diverso da uno spettro continuo?

Spettro continuo: uno spettro che ha tutte le lunghezze d'onda senza interruzioni su un ampio intervallo. Spettro di emissione: quando un elettrone in uno stato eccitato si sposta a un livello energetico inferiore, emette una certa quantità di energia sotto forma di fotoni. Lo spettro per questa transizione è costituito da linee perché i livelli di energia sono quantizzati
Lo spettro di emissione atomica è una gamma continua di colori?

T/F Come lo spettro visibile, uno spettro di emissione atomica è una gamma continua di colori. T/F Ogni elemento ha uno spettro di emissione atomica unico. V/F Il fatto che solo determinati colori appaiano in uno spettro di emissione atomica di elementi indica che vengono emesse solo determinate frequenze di luce
Perché lo spettro di assorbimento per la clorofilla a e lo spettro di azione per la fotosintesi sono diversi?
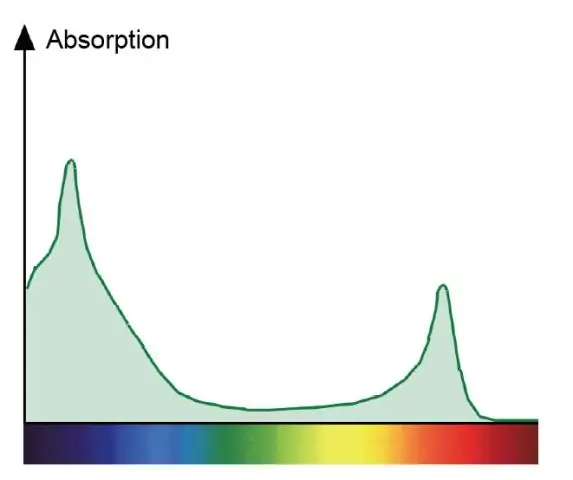
Uno spettro di assorbimento mostra tutti i colori della luce assorbita da una pianta. Uno spettro d'azione mostra tutti i colori della luce utilizzati nella fotosintesi. Le clorofille sono i pigmenti verdi che assorbono il rosso e il blu e partecipano direttamente alla fotosintesi
Qual è lo spettro di emissione del sole?

Lo spettro di emissione del Sole. Il Sole emette radiazioni elettromagnetiche su un'ampia gamma di lunghezze d'onda. Il massimo nello spettro di emissione solare è a circa 500 nm, nella parte blu-verde dello spettro visibile. Oltre alla luce visibile, il Sole emette radiazioni ultraviolette e radiazioni infrarosse
