
- Autore Miles Stephen [email protected].
- Public 2023-12-15 23:37.
- Ultima modifica 2025-01-22 17:02.
isotopi hanno masse atomiche diverse. L'abbondanza relativa di ciascuno isotopo può essere determinato usando spettrometria di massa . UN spettrometro di massa ionizza atomi e molecole con un fascio di elettroni ad alta energia e quindi devia gli ioni attraverso un campo magnetico in base alla loro messa -rapporti di carica (m / z m/z m/z).
In questo caso, in che modo i dati della spettrometria di massa dimostrano l'esistenza degli isotopi?
No, la maggior parte degli elementi esistere in natura come diverso isotopi dello stesso elemento. Quando un campione di un elemento puro è analizzato con a spettrometro di massa , ogni isotopo essere ionizzato e rilevato. Il messa lo spettro rappresenta ciascuno isotopo come un picco, tracciando il suo messa rapporto di carica (m/z) e la sua intensità relativa.
Inoltre, come si calcola la massa media di un isotopo? Per calcolare il massa media , converti prima le percentuali in frazioni (dividile per 100). Quindi, calcolare il messa numeri. Il cloro isotopo con 18 neutroni ha un'abbondanza di 0,7577 e a messa numero di 35 amu.
Di conseguenza, come fa la spettrometria di massa a identificare i composti?
Il più alto- messa ione in a lo spettro è normalmente considerato lo ione molecolare, e messa ioni sono frammenti dallo ione molecolare, assumendo il campione è un singolo puro composto . Anche se questi i composti sono molto simile nelle dimensioni, è è una cosa semplice da identificare loro dal loro individuo messa spettri.
Che cosa ha una massa di 1 amu?
Un'unità di massa atomica (simboleggiata AMU o amu) è definita esattamente come 1/12 della massa di un atomo di carbonio-12. L'atomo di carbonio-12 (C-12) ha sei protoni e sei neutroni nel suo nucleo. In termini imprecisi, un AMU è la media dei protone massa a riposo e neutrone massa a riposo.
Consigliato:
In che modo gli isotopi differiscono dagli atomi medi dello stesso elemento?

Gli isotopi sono atomi con lo stesso numero di protoni ma che hanno un diverso numero di neutroni. Poiché il numero atomico è uguale al numero di protoni e la massa atomica è la somma di protoni e neutroni, possiamo anche dire che gli isotopi sono elementi con lo stesso numero atomico ma diverso numero di massa
In che modo gli isotopi di un elemento differiscono quizlet?

Gli isotopi dello stesso elemento sono diversi perché hanno un numero diverso di neutroni e quindi numeri atomici diversi. Nonostante le differenze nel numero di neutroni, gli isotopi sono chimicamente simili. Hanno numeri identici di protoni ed elettroni, che determinano il comportamento chimico
Come si dimostra che la somma degli angoli esterni di un triangolo è 360?

Un angolo esterno di un triangolo è uguale alla somma degli angoli interni opposti. Per ulteriori informazioni su questo vedere il teorema dell'angolo esterno del triangolo. Se si prende l'angolo equivalente in ogni vertice, gli angoli esterni si sommano sempre a 360° In effetti, questo è vero per qualsiasi poligono convesso, non solo per i triangoli
In che modo l'effetto fotoelettrico dimostra la dualità delle particelle d'onda?
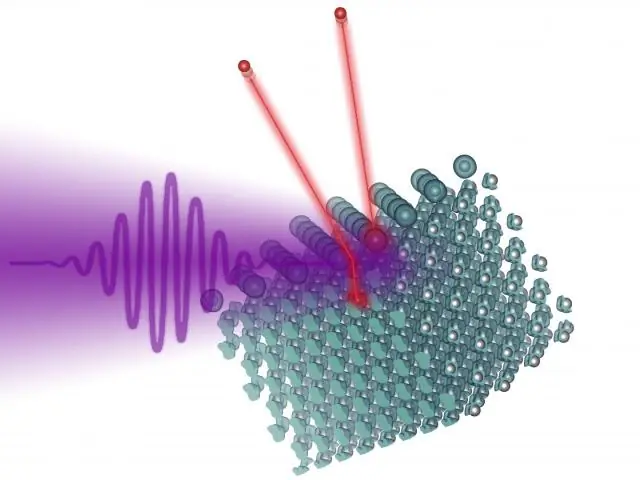
La teoria dell'effetto fotoelettrico di Albert Einstein contribuì notevolmente alla teoria di De Broglie e fu una prova che onde e particelle potevano sovrapporsi. La luce può anche essere osservata come una particella nota come fotone. Quindi, se un fotone di energia maggiore di quella di un elettrone colpisce un solido, quell'elettrone verrà emesso
Quale degli articoli del 1905 diede la prima buona prova teorica dell'esistenza degli atomi?

Carte Annus mirabilis
