
- Autore Miles Stephen [email protected].
- Public 2023-12-15 23:37.
- Ultima modifica 2025-06-01 05:04.
quando HCl le molecole si dissolvono dissociarsi in H+ ioni e Cl- ioni. HCl è un acido forte perché si dissocia quasi completamente. Al contrario, un acido debole come l'acido acetico (CH3COOH) fa non dissociarsi bene dentro acqua - molti H+ gli ioni rimangono legati all'interno della molecola.
Successivamente, ci si potrebbe anche chiedere, l'HCl si ionizza nell'acqua?
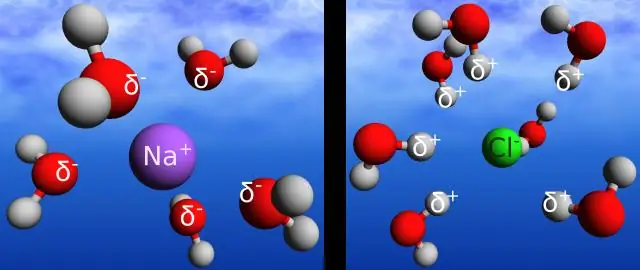
Cloruro di idrogeno ( HCl ) ionizza completamente in ioni idrogeno e ioni cloruro in acqua . Un acido debole è un acido che ionizza solo leggermente in una soluzione acquosa. Acidi deboli, come acidi forti, ionizzare per produrre l'H + ione e una base coniugata. Perché HCl è un acido forte, la sua base coniugata (Cl −) è estremamente debole.
Inoltre, come si dissocia l'acido cloridrico in acqua? Forte acidi o le basi possono dissociarsi completamente quando posto in una soluzione di acqua . HCl è forte acido con un valore di pH compreso tra 0 e 2. Riassumendo, quando HCl si dissolve in acqua , i suoi componenti dissociarsi in ioni H+ e ioni Cl- quando il legame covalente viene rotto tra di loro.
Di conseguenza, le basi si dissociano in acqua?
Arrhenius ha sostenuto che basi sono composti neutri che sia dissociarsi o ionizza in acqua dare OH- ioni e uno ione positivo. NaOH è un Arrhenius base perché si dissocia in acqua per dare l'idrossido (OH-) e sodio (Na+)ioni.
Gli acidi deboli si dissociano in acqua?
UN acido debole è uno che fa non dissociarsi completamente in soluzione; questo significa che a l'acido debole non non donare tutti i suoi ioni idrogeno (H+) in una soluzione. La maggioranza di acidi sono debole . In media, solo l'1% circa di a acido debole soluzione si dissocia in acqua in una soluzione 0,1 mol/L.
Consigliato:
Qual è l'attività dell'acqua dell'acqua pura?

L'attività dell'acqua si basa su una scala da 0 a 1,0, con acqua pura avente un valore di 1,00. È definita come la tensione di vapore dell'acqua su un campione divisa per la tensione di vapore dell'acqua pura alla stessa temperatura. In altre parole, più acqua non legata abbiamo, più probabilità abbiamo di deterioramento microbico
In che modo il legame idrogeno tra le molecole d'acqua può aiutare a spiegare la capacità dell'acqua di assorbire grandi quantità di energia prima dell'evaporazione?
I legami idrogeno nell'acqua le permettono di assorbire e rilasciare energia termica più lentamente di molte altre sostanze. La temperatura è una misura del movimento (energia cinetica) delle molecole. All'aumentare del movimento, l'energia è più alta e quindi la temperatura è più alta
Il CuSO4 si dissocia in acqua?

Quando CuSO4 o CuSO4. 5H2O sono dissolti in H2O (acqua) si dissociano (dissolve) in ioni Cu 2+ e SO4 2-. Il (aq) mostra che sono acquosi – disciolti in acqua
Ch3ch2oh si dissocia in acqua?

CH3CH2OH, noto come etanolo, è un alcol che ha una catena idrofoba molto corta e un gruppo idrofilo. Gli alcoli sono in grado di dissolversi in acqua a causa del gruppo alcolico alla fine, ma man mano che la catena di carbonio si allunga o si ingrandisce (a causa della ramificazione), la solubilità diminuisce
Il nitrato di calcio si dissocia in acqua?

Quando Ca(NO3)2 viene sciolto in H2O (acqua) si dissocia (dissolve) in ioni NH4+ e 2NO3-. Per mostrare che sono disciolti in acqua possiamo scrivere (aq) dopo ciascuno. Il (aq) mostra che sono acquosi - disciolti in acqua
