
- Autore Miles Stephen [email protected].
- Public 2023-12-15 23:37.
- Ultima modifica 2025-01-22 17:02.
C8H18
Qual è qui la formula empirica dell'ottano c8h18?
Il formula empirica di ottano $$C_{8}H_{18}$$ è: A. B. C.
Allo stesso modo, qual è la formula empirica di c2h6o2? Formule molecolari ed empiriche
| Domanda | Risposta |
|---|---|
| Scrivi la formula empirica per il seguente composto: C6H8 | C3H4 |
| Scrivi la formula empirica per il seguente composto: X39Y13 | X3Y |
| Qual è la formula empirica per il composto WO2? | WO2 |
| Scrivi la formula empirica per il composto C2H6O2? | CH3O |
Sappi anche, come trovi la formula empirica?
Inizia con il numero di grammi di ciascun elemento, indicato nel problema. Converti la massa di ciascun elemento in moli usando la massa molare della tavola periodica. Dividi ogni valore di mole per il minor numero di mole calcolate.
Quali sono gli isomeri dell'ottano?
Ottano ha 18 strutturali isomeri (24 inclusi gli stereoisomeri): Ottano (n- ottano ) 2-metileptano. 3-metileptano (2 enantiomeri)
Consigliato:
Perché la formula empirica dell'ossido di magnesio MgO?

La formula empirica per l'ossido di magnesio è MgO. Il magnesio è un catione +2 e l'ossido è un anione -2. Poiché le cariche sono uguali e opposte, questi due ioni si legheranno insieme in un rapporto di atomi di 1 a 1
Qual è la formula empirica per la caffeina?
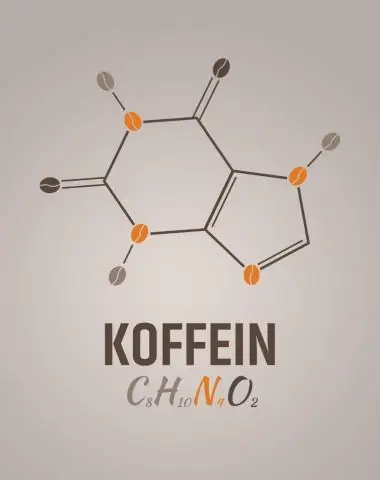
2 risposte. C8H10N4O2 è la formula molecolare della caffeina
Qual è la capacità termica specifica dell'ottano?

Nomi di ottano Capacità termica (C) 255,68 J K−1 mol−1 Entropia molare standard (So298) 361,20 J K−1 mol−1 Entalpia standard di formazione (ΔfH?298) −252.1–−248,5 kJ mol− 1 Entalpia standard di combustione (ΔcH?298) −5.53–−5.33 MJ mol−1
La combustione dell'ottano è endotermica o esotermica?

La combustione del metano o dell'ottano è esotermica; sprigiona energia
Che cos'è la formula empirica e la formula molecolare?
Le formule molecolari ti dicono quanti atomi di ciascun elemento ci sono in un composto e le formule empiriche ti dicono il rapporto più semplice o più ridotto degli elementi in un composto. Se la formula molecolare di un composto non può più essere ridotta, la formula empirica è la stessa della formula molecolare
