
- Autore Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- Ultima modifica 2025-06-01 05:04.
La presenza di solo alcune righe nell'atomo spettri significava che un elettrone può adottare solo determinati livelli energetici discreti (l'energia è quantizzata); da qui l'idea di quanto conchiglie . Le frequenze dei fotoni assorbite o emesso da un atomo sono fissati dalle differenze tra i livelli di energia delle orbite.
A questo proposito, in che modo il modello di Bohr spiegava gli spettri di emissione degli atomi?
Il modello di Bohr dell'idrogeno atomo ha dato una spiegazione esatta per il suo osservato spettro di emissione . Gli elettroni possono spostarsi da un'orbita all'altra assorbendo o emettendo energia, dando origine a caratteristiche spettri.
quali prove supportano il modello di Bohr? Modello Bohr e spettri atomici The prova abituato a sostenere il modello di Bohr proveniva dagli spettri atomici. bohr suggerito che uno spettro atomico viene creato quando gli elettroni in un atomo si muovono tra i livelli di energia.
Rispetto a questo, che prove ci sono per gli elettroni nei gusci?
Energia di ionizzazione - la prova per conchiglie e sub- conchiglie L'energia di ionizzazione è un misura di il quantità di energia necessaria per rimuovere elettroni dagli atomi. Come elettroni sono caricati negativamente e i protoni in il nucleo sono carichi positivamente, là sarà un'attrazione tra loro.
Come si trova lo spettro di emissione?
Le frequenze di luce che un atomo può emettere dipendono dagli stati in cui possono trovarsi gli elettroni. Quando eccitato, un elettrone si sposta a un livello di energia superiore o orbitale. Quando l'elettrone ricade al suo livello del suolo, la luce è emesso.
Consigliato:
Perché gli elettroni più esterni sono gli unici inclusi nel diagramma a punti elettronici?

Gli atomi con 5 o più elettroni di valenza acquisiscono elettroni formando uno ione negativo, o anione. perché gli elettroni più esterni sono solo quelli inclusi nel diagramma di riempimento orbitale? sono gli unici coinvolti nelle reazioni chimiche e nel legame. L'orbitale 2s è più lontano dal nucleo, il che significa che ha più energia
In che modo le frane e le colate di fango sono simili In che modo sono diverse?

La gravità provoca movimenti di massa. Frane, colate di fango, creep e pendii sono agenti di erosione. Le frane contengono solo roccia e terreno, mentre le colate di fango contengono roccia, terreno e un'alta percentuale di acqua
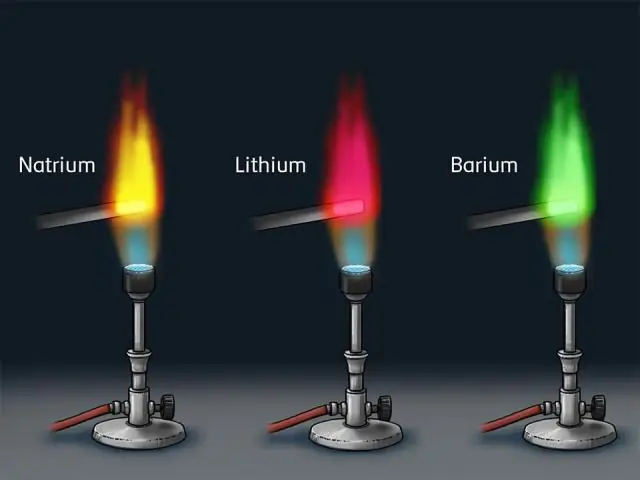
Come sono le prove degli spettri di emissione per i gusci di elettroni?

La presenza di solo determinate righe negli spettri atomici significava che un elettrone può adottare solo determinati livelli energetici discreti (l'energia è quantizzata); da qui l'idea dei gusci quantistici. Le frequenze dei fotoni assorbite o emesse da un atomo sono fissate dalle differenze tra i livelli energetici delle orbite
In che modo Niels Bohr ha descritto gli elettroni nel suo modello atomico?
Modello atomico di Bohr: Nel 1913 Bohr propose il suo modello a guscio quantizzato dell'atomo per spiegare come gli elettroni possono avere orbite stabili attorno al nucleo. L'energia di un elettrone dipende dalla dimensione dell'orbita ed è inferiore per orbite più piccole. La radiazione può verificarsi solo quando l'elettrone salta da un'orbita all'altra
In che modo il modello di Bohr spiega gli spettri atomici?

Niels Bohr spiegò lo spettro lineare dell'atomo di idrogeno assumendo che l'elettrone si muovesse su orbite circolari e che fossero consentite orbite con solo determinati raggi. L'orbita più vicina al nucleo rappresentava lo stato fondamentale dell'atomo ed era più stabile; le orbite più lontane erano stati eccitati ad energia più alta
